Полиоксидоний при раке молочной железы
Электронный научный журнал
Современные проблемы науки и образования
ISSN 2070-7428
«Перечень» ВАК
ИФ РИНЦ = 0,931
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Козель Ю.Ю. 1 Кузнецов С.А. 1 Старжецкая М.В. 1 Мкртчян Г.А. 1 Пак Е.Е. 1 Алавердян И.А. 1
1 ФГБУ «Ростовский научно-исследовательский онкологический институт» Минздрава России
Полихимотерапия, являясь ведущим методом в составе комплексной терапии детской онкологической патологии, вызывает спектр осложнений, одним из которых является иммуносупрессия с развитием инфекционных осложнений. Проведено исследование возможности применения иммуномодулятора полиоксидоний в качестве сопроводительной терапии полихимиотерапии у детей с солидными злокачественными опухолями. В исследование включены 20 детей с различными солидными злокачественными опухолями, которым применялся препарат полиоксидоний на фоне курса ПХТ. Группой сравнения послужили 30 детей с солидными злокачественными опухолями, которым полихимиотерапия проведена без включения полиоксидония. В результате исследования выявлено, что применение полиоксидония не влияет на течение онкологического процесса, однако отмечаются снижение частоты инфекционных осложнений, снижение тяжести иммуносупрессии, достоверное снижение частоты лейкопении III и IV степени тяжести.
полиоксидоний
полихимиотерапия
дети
1. Гордина Г.А., Короткова О.В., Киселев A.B. Иммуномодулятор полиоксидоний в комплексном лечении детей с гистиоцитозом Лангерганса и лимфомой Ходжкина. // Сб. статей: Применение иммуномодулятора полиоксидоний в онкологии. — М., 2005. — С. 4-10.
2. Желудкова О.Г., Коршунов А.Г., Бородина И.Д. и соавт. Комплексное лечение медуллобластом у детей старше 3 лет. [Электронный ресурс] // M. III съезд детских онкологов и гематологов. 2004 (дата обращения 03.03.2015).
3. Козель Ю.Ю. Лимфохимиотерапия в комплексном лечении местно-распространенного рака органов полости рта и ротоглотки. Автореф. дис… канд. мед. наук. — Ростов н/Д, 2001. — 33 с.
4. Копосов П.В., Ковалев В.И., Ковалев Д.В. Профилактика и лечение осложнений химиотерапии злокачественных опухолей у детей. Современные подходы: Руководство для врачей. — М., 2002. — 115 с.
5. Лусс Л.В. Применение полиоксидония у онкологических больных // Сб. статей: Применение иммуномодулятора полиоксидоний в онкологии. — М.: 2005. — С. 45-46.
6. Мазнюк Л.В., Артамонова Е.В., Кадагидзе З.Г. и соавт. Результаты применения полиоксидония у больных раком молочной железы // Сб. статей: Применение иммуномодулятора полиоксидоний в онкологии. — М.: 2005. — С. 22-25.
7. Шельцина Т.Д., Марчук Е.В., Бутакова А.А., Применение полиоксидония при распространенных формах рака толстой кишки // Сб. статей: Применение иммуномодулятора полиоксидоний в онкологии. — М.: 2005. — С. 47-50.
8. Hockel M. et al. // Cancer Res. — 1996. — Vol.56. — P. 4509-45_15s
9. Parney I.F., Hao Ch., Petruk K.C. Glioma Immunology and Immunoterapy.//Neurosurg. — 2000. — Vol. 46. № 4. — P. 778-792.
Полихимиотерапия (ПХТ) на современном этапе развития детской онкологии является ведущим методом в составе комплексной терапии в детской онкологической практике. Интенсификация схем химиотерапии (увеличение доз, уменьшение интервалов между введениями) позволила значительно улучшить результаты лечения и, соответственно, повысить выживаемость в детской онкологической практике [2, 9].
Нужно отметить, что наряду с цитопатическим действием цитостатических агентов на опухолевые клетки повреждаются и здоровые ткани организма, нарушаются его гомеостаз, физиологическое взаимодействие органов и систем. Искусство проведения цитостатического лечения связано прежде всего не с формальным соблюдением режима введения химиопрепарата в организм больного, а с профилактикой и лечением острых и отсроченных осложнений химиотерапии, т.е. с искусством сопроводительного лечения [4]. При проведении длительной многокурсовой дозоинтенсивной ПХТ у детей встречается весь спектр осложнений: ургентные состояния (в том числе синдром острого лизиса опухолевых клеток, гиперлейкоцитоз и другие метаболические и эндокринные нарушения, кровотечения); миелодепрессия, чаще всего нейтропения и анемия; инфекционные осложнения, возникающие на фоне 100%-ной иммуносупрессии, в том числе фебрильная нейтропения, септические состояния [4, 8]. В настоящее время ведется активный поиск средств и лекарственных препаратов, позволяющих уменьшить частоту встречаемости вышеперечисленных осложнений, в том числе и осложнений, связанных с иммуносупрессией: инфекционных осложнений (вирусных, бактериальных, грибковых инфекций). Перспективным направлением в профилактике иммунной недостаточности и развитии инфекционных осложнений на фоне противоопухолевой химиотерапии является применение отечественного препарата полиоксидоний с преимущественным влиянием на моноцитарно-макрофагальное и нейтрофильное звено иммунной системы. Полиоксидоний с успехом используется в сопроводительной терапии химиолучевого лечения различных онкологических заболеваний, таких как рак молочной железы, рак толстой кишки, рак гортани, рак прямой кишки, и не оказывая влияния на клиническое течение и прогноз самого заболевания, улучшает тем не менее переносимость химиотерапии, нормализует лабораторные показатели, восстанавливает показатели иммунного статуса больного [5, 6, 7]. В частности, у детей известно применение полиоксидония в комплексном лечении лимфомы Ходжкина и лангергансово-клеточного гистиоцитоза [1, 3].
В нашей практике мы применяли иммунотропный препарат полиоксидоний в качестве сопроводительной терапии полихимиотерапии у детей с солидными злокачественными опухолями. Полиоксидоний назначался после окончания каждого курса полихимиотерапии подкожно в дозе 0,15 мг на 1 кг массы тела ребенка 1 раз в день в течение 5 дней.
Целью исследования явилось изучить эффективность применения полиоксидония в сопроводительной терапии комплексного лечения детей и подростков с солидными злокачественными опухолями.
Материалы и методы
Клиническим материалом для исследования послужили данные 50 детей и подростков в возрасте от 6 до 18 лет, проходивших лечение в отделении детской онкологии РНИОИ по поводу солидных злокачественных новообразований, за период с 2005 по 2011 гг. Больные были разделены на 2 группы: основная группа — 20 больных, которым наряду с полихимиотерапией проводили иммунокорригирующую терапию полиоксидонием, контрольная группа — 30 больных, которым проводилась полихимиотерапия без применения полиоксидония (таблица).
Распределение нозологических форм солидных опухолей у детей и подростков в исследуемых группах
Нозологические формы опухолей | Количество больных (всего) (абс./%) | |
Основная группа | Контрольная группа | |
Саркома Юинга | 3 (15%) | 10 (33,4%) |
Остеогенная саркома | 2 (10%) | 6 (20%) |
Герминогенные опухоли | 4 (20%) | 4 (13,3%) |
Нейробластома | 3 (15%) | 4 (13,3%) |
Рабдомиосаркома | — | 3 (10%) |
Рак носоглотки | 7 (35%) | 3 (10%) |
Нефробластома | 1 (5%) | — |
Всего: | 20 (100%) | 30 (100%) |
В основной группе, где применялся полиоксидоний, индукционная терапия проведена 14 больным (58 курсов), и на этапе консолидирующей терапии — 16 больным (54 курса). Полихимиотерапия без применения полиоксидония проводилась 27 больным на этапе индукционной терапии (94 курса), 26 больным — на этапе консолидирующей терапии (122 курса).
Всем детям и подросткам с солидными злокачественными новообразованиями результаты проведенной ПХТ оценивали по принятым в детской онкологии критериям — полный эффект (ПЭ); выраженный клинический эффект (ВКЭ); частичный клинический эффект (ЧЭ); стабилизация заболевания (СЗ); прогрессирование заболевания (ПЗ) [4]. Степень выраженности острых и подострых токсических эффектов от цитостатической терапии оценивали по модифицированной международной шкале Европейского общества онкологов-педиатров (SIOP).
Для оценки иммунного статуса производили забор крови для иммунологического исследования перед каждым курсом и на 10-14-й день от начала каждого курса химиотерапии. В качестве контроля использовали иммунологические показатели здоровых детей соответствующей возрастной группы. Фенотипирование лейкоцитов из образцов цельной крови выполняли по стандартной методике проточной цитометрии с использованием флюорохром-конъюгированных моноклональных антител. Анализ проводили на цитофлюорометрах BD Facs Cantoo II.
С целью оценки активности нейтрофильного звена иммунитета определяли интенсивность кислородозависимых реакций с помощью спонтанного и стимулированного латексом теста восстановления нитросинего тетразолия до диформозана (НСТ-теста), с вычислением индекса стимуляции нейтрофилов.
Результаты
В результате проведенной индукционной полихимиотерапии в контрольной группе выраженный клинический эффект достигнут у 7 пациентов (25,9%), в основной группе достигнут у 4 пациентов (28,5%). Частичный клинический эффект в контрольной группе получен при лечении 13 пациентов (48,6%), в основной группе частичного клинического эффекта удалось добиться у 7 пациентов (50%). Стабилизация в течении заболевания достигнута в контрольной группе у 5 (18,6%), в основной группе у 2 пациентов (14,3%). У 2 детей в контрольной группе отмечалось прогрессирование опухолевого процесса (7,4%) и в основной группе у 1 пациентки с эйстейзионейробластомой III стадии (7,1%). Полный клинический эффект по критериям SIOP на этапе индукционного лечения не был достигнут ни у одного пациента (рис. 1).
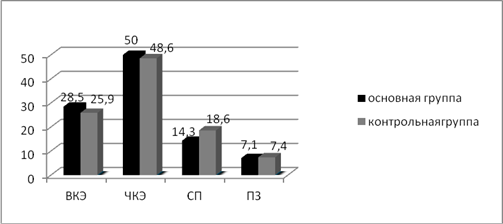
Рис. 1. Процентное соотношение эффективности индукционной терапии в исследуемых группах
Анализируя проведенную консолидирующую ПХТ (контрольная группа), необходимо отметить, что у 17 пациентов она была выполнена после радикального удаления опухоли или лучевой терапии. Полный клинический эффект после проведенной консолидирующей ПХТ имели 15 пациентов (57,7%), выраженный клинический эффект — 4 пациента (15,4%), стабилизация заболевания была у 4 пациентов (15,4%), прогрессия заболевания на этапе консолидирующей ПХТ и по ее окончании наступила у 3 пациентов (11,5%) (рис. 2).
В основной группе консолидирующую ПХТ с иммунокоррекцией в качестве адъювантного лечения после радикальной операции или лучевой терапии провели 9 больным. Полный клинический эффект отмечен у 11 больных (56,6%), выраженный клинический эффект — у 2 пациентов (12,5%). Стабилизация заболевания наблюдалась у 3 больных (18,7%), прогрессия заболевания наступила у 2 пациентов (12,5%). Анализируя приведенные выше данные, можно сказать, что достоверных отличий в непосредственных результатах между ПХТ и ПХТ с полиоксидонием не выявлено (рис. 2).
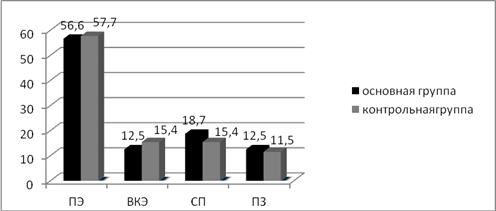
Рис. 2. Процентное соотношение эффективности консолидирующей терапии у больных в исследуемых группах
Оценивая токсичность и инфекционные осложнения проводимой терапии, мы получили следующие результаты: в контрольной группе, где применялась полихимиотерапия без использования полиоксидония из 216 курсов, анемией III степени осложнились 15 курсов (6,9%), IV степени — 4 (1,8%). Лейкопения III степени зарегистрирована после 27 курсов (12,5%), IV степени — после 10 курсов (4,6%). С целью купирования лейкопении III и IV степени, а также для профилактики острых септических осложнений вводился КСФ (нейпоген, граноцит) после 26 курсов (12%) ПХТ. Развитие агранулоцитоза в сочетании с иммунодепрессией в 6 наблюдениях (2,8%) привело к развитию фебрильной нейтропении, для купирования которой пациенты получали КСФ, антибактериальную, антимикотическую и антипневмоцистную терапию. Осложнения бактериальной природы (поражение кожи, пневмонии, цистит) на фоне проведения ПХТ отмечены после 9 курсов (4,2%), грибковые поражения — после 4 курсов (1,8%) ПХТ. Осложнения вирусной природы были представлены острой респираторной вирусной инфекцией, что вызывало необходимость прерывания или откладывания начала курса аутогемохимиотерапии в 12,9% (28 курсов), а также простым герпесом после 10 курсов ПХТ (4,6%). С целью купирования анемии III и IV степени вводился эритропоэтин (рекармон, эпрекс) после 11 курсов (5,1%) системной полихимиотерапии (рис. 3, 4).
В основной группе, где применялась полихимиотерапия с иммунокоррекцией полиоксидонием, анемия III степени отмечалась на 2 курсах у 1 пациента с (1,8%), IV степени — на 2 курсах у 1 пациентки (1,8%), этим больным с целью купирования анемии вводился эритропоэтин (рекармон).
Лейкопенией III степени в основной группе осложнилось 10 курсов ПХТ (8,9%), лейкопения IV степени зарегистрирована после 2 курсов ПХТ (1,8%). При всех курсах, осложнившихся лейкопенией IV степени, и при 6 курсах, осложнившихся лейкопенией III степени (14,3%), вводились КСФ (нейпоген, граноцит, грасальва). Фебрильная нейтропения отмечалась у 1 пациентки после 2 курсов (1,8%) ПХТ с применением иммунокоррекции полиоксидонием. Осложнения бактериальной природы (поражение кожи, пневмонии, цистит) на фоне проведения ПХТ с иммунокоррекцией отмечены после 2 курсов (1,8%), грибковых поражений не было зарегистрировано ни на одном курсе ПХТ с иммунокоррекцией. Явления стоматита различной степени тяжести зарегистрированы после 4 курсов (3,6%). Острая респираторная вирусная инфекция наблюдалась на 11 курсах ПХТ с иммунокоррекцией (9,8%), герпетическая инфекция отмечалась после 3 курсов (2,7%) (рис. 3, 4).
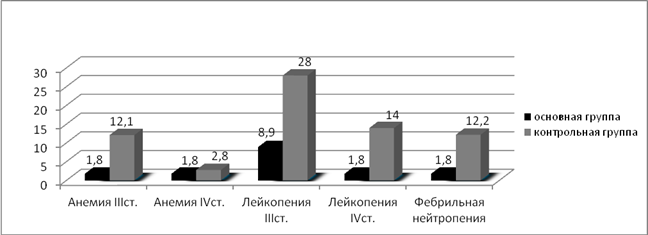
Рис. 3. Процентное соотношение эффективности индукционной терапии у больных в исследуемых группах
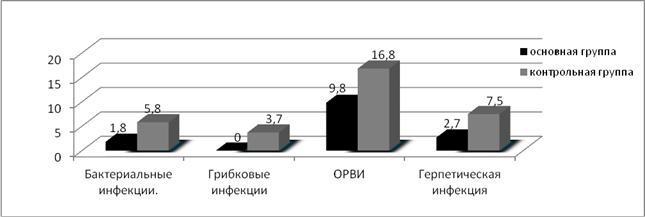
Рис. 4. Процентное соотношение инфекционных осложнений на фоне курсов ПХТ в исследуемых группах
При изучении иммунного статуса у пациентов до лечения отмечалось достоверное снижение по сравнению со здоровыми детьми относительных показателей иммунограммы CD20-лимфоцитов на 15%, CD4 — на 25,7% и CD25 — на 40%. Из абсолютных значений иммунограммы достоверно также снижались показатели CD20 — на 16,7%, CD4 — на 30,9% и CD25 — на 42,9%. По остальным абсолютным показателям достоверных отличий не выявлено.
Нами проведена оценка иммунного статуса больных после проведенной химиотерапии на 10-14-й день от начала курса, т.е. в момент развития максимальной миелосупрессии. В контрольной группе, где больные проходили системную полихимиотерапию, отмечено снижение процентного содержания Т-клеток — достоверно снижаются уровни CD2+, CD4+, CD25+ лимфоцитов, а также СD20+лимфоцитов. В отношении других количественных показателей иммунограммы достоверных изменений не выявлено. При изучении абсолютных значений выявлено достоверное снижение уровня всех иммунокомпетентных клеток по сравнению с исходным уровнем, что обусловлено развитием миелосупрессии после курса системной полихимиотерапии.
В основной группе, где больные проходили полихимиотерапию с полиоксидонием, также отмечено угнетение иммунного статуса как по Т-клеточному звену, так и по В-клеточному звену. Однако по сравнению с контрольной группой отмечаются достоверные положительные различия по CD2 на 12%, CD20 на 12,8%, CD4 на 25,4%. При изучении абсолютных значений количества иммунокомпетентных клеток в основной группе выявлено достоверное улучшение показателей CD2 на 13%, CD4 на 17,2% по сравнению с контрольной группой, что обусловлено менее выраженной миелосупрессией в основной группе. Иммунорегуляторный индекс в основной группе после каждого курса полихимиотерапии с полиоксидонием был выше, чем в контрольной группе (1,17 против 0,85 соответственно) (р<0,05).
С целью оценки влияния полиоксидония на фагоцитарное звено иммунитета исследовали индекс стимуляции нейтрофилов в НСТ-тесте. Оказалось, что индекс стимуляции нейтрофилов у больных, получавших полиоксидоний на фоне полихимиотерапии, достоверно выше, чем у больных на фоне системной полихимиотерапии (1,3 против 0,89 соответственно) (р<0,05).
Выводы:
1. Достоверных отличий в непосредственных результатах лечения между ПХТ и ПХТ с использованием полиоксидония не выявлено.
2. Применение полиоксидония при полихимиотерапии способствует снижению частоты инфекционных осложнений бактериальной природы — 1,8 % и вирусной природы — 12,5% по сравнению с системной полихимиотерапией (6,5% и 24,3% соответственно) (р<0,05).
3. Применение полиокидония на фоне полихимиотерапии позволяет снизить тяжесть иммуносупрессии и достигнуть достоверного улучшения иммунологических показателей, характеризующих Т-клеточное звено и фагоцитарное звено (индекс стимуляции нейтрофилов) (р<0,05).
4. Применение полиоксидония при проведении полихимиотерапии сопровождается достоверным снижением частоты лейкопении III и IV степени тяжести (8,9% и 1,8% соответственно) по сравнению с обычной полихимиотерапией (28% и 14% соответственно) (р<0,05).
Рецензенты:
Николаева Н.В., д.м.н., ассистент кафедры онкологии Ростовского государственного медицинского университета, г. Ростов-на-Дону;
Каймакчи О.Ю., д.м.н., ассистент кафедры онкологии Ростовского государственного медицинского университета, г. Ростов-на-Дону.
Библиографическая ссылка
Козель Ю.Ю., Кузнецов С.А., Старжецкая М.В., Мкртчян Г.А., Пак Е.Е., Алавердян И.А. ПРИМЕНЕНИЕ ИММУНОМОДУЛЯТОРА ПОЛИОКСИДОНИЙ В СОПРОВОДИТЕЛЬНОЙ ТЕРАПИИ ПРИ ЛЕЧЕНИИ ДЕТЕЙ С СОЛИДНЫМИ ЗЛОКАЧЕСТВЕННЫМИ ОПУХОЛЯМИ // Современные проблемы науки и образования. — 2015. — № 4.;
URL: https://science-education.ru/ru/article/view?id=21389 (дата обращения: 06.06.2021).

Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
..
: /. . . — : , 2002. — . 21-32.
, , , , , . , — , — , , . ( ) . 2002 .
70- . XX , . 30 :
1. , . .
2. ():
) (, Roche, , 1 . 0,5 — 2400 $) — CD20 — . — ,
) (, Roche, , 1 . 0,44 — 3000 $) — HER2-neo, , . .
. , , , , » » .
30 . , .
3. :
) LAK-, -, -2,
) ( , , ),
) TIL- ( , ),
) ( ).
.
4. .
. , , .
.
) , ( , . . . . . ) , , , , , , , [9].
) . .
) (. , . . ..) [8].
, 40 , , , . , , .
5. — .
) , (IL-2, IL-4, IL-7, IL-10, , -), .
) , .
, , . , , , , , , .
, ( ). . . , .
, , , , , . , , . . ( «» 2 2002 ).
,
| — | 10 . — 1,8 $ | 5 . | |
| 10 — . — 1 $ | 10 . | ||
| — | 20 . — 4,7 $ | 60-80 . | |
| (, ), | 10 . — 4,0 $ | 5 — 6 . | |
) — ) ) (III, IV ) | 5 — 7.4 $. | ) 5 -10 . ) 5 -10 . ) 5-7 | |
| ) — ) | 10 . — 19,3 $. | 5 -10 . | |
) II-IV , — , ) , — | 1 . — 42,0 $ | 5 . | |
| ) ) ) , . | 1 . 500 . — 13,5 $ | ) 16 80 . ) 2 -3 . | |
| 1 . 400$ | 80 . | ||
) — ) ) | 10 .- 50,0 $ | ) 10-15 . )5 . ) 150 . | |
| , | 5 . -920$ | 5 . | |
| 5 . -1430$ | |||
| 5 . -780$ | |||
| , , , . : , , , — , , , | . 1 . — 15,5 $ | 10 360 . | |
| . 3 . — 27$ | |||
| . 3 . — 32$ | |||
| . 3 . — 3,3 $ | |||
| — | . 3 . — 32$. | ||
| «» | , in situ | 1 20 — 1,0$ | 72 . |
| ) [1, 2] ) | . 1 10 — 5,0 $, . 10 10 — 24,2 $ | ) 14 . 10 ) 10-60 . 1 | |
| ) , , — ) , — | 5 . — 34,0 $ | 5 -10 . | |
| , , — . | 1 . — 3,0 $ | 3 . | |
| , — | 1 . — 58,0 $ | 3- 5 . | |
| ) — ) ( , ) | . 0,2 30 -5,0 $ | ) 150 . ) 90 . | |
| ( ) | |||
| ) — ) ) [5] | 5 6 — 26,7 $ | ) 10-20 . ) 10 . ) 50 . | |
| ) , , — ) , — ) , ( ) | 5 1% — 1 — 25,5 $ 5 1% — 2 — 36,0 $. 5 3% — 1 — 40,0 $ 5 3% — 2 — 57,2 $ | ) 10 3%-1 5 3%-2 ) 30 . 1%-1 ) 1%-1 | |
| — | 1 . — 7,7 $ | 25 . | |
| ) ) ) , , , [6] | 5 . — 5,6 $ | ) 16 -24 . ) 5-8 . | |
| ) , , — , ) ( ). | 2 . 50 — 0,8$ | 200 . | |
, -, , -. — .
— , . [4, 5]. ( ) , , [8]. — .
, , . III-IY , [3 ].
( 1-4 N 1- 1-) . 70% . — — . , — [7 ].
() , , , , .
. , , , [10]. (. ).
, , ( — -2) , , — . .
, . , , .
. .
, , , . . .
, ( , ), .
, , — , , , , , .
— , — , , , , .
— , : (, , ), , , , , , .
, , , — , , .
III — IV — , — , , , .
, . , : , -, .
:
1. .., .., .. // 8 » «. . , 2001. . 294
2. .., .. // . . 301.
3. .., .., .. . // . , . .
4. .., .., .. . // 8 » «. . , 2001. . 271.
5. . ( ), 1. ., .. , «».- 44 .
6. . .. . .. … — , «» .- . 2001. — 110 .
7. . — . .: «», 2000. — 16 .
8. / .., .. , .. . — .: — .. -, 2001 — 88 .
9. : https://www.transplantation.ru
10. , : https://www.institut-harz.com/cancertherapytotal.htm, https://www.dr-kroiss.at/Galavit, https://www.galavitum.de, https://www.vrzverlag.com/esoterik/legalavi.htm, https://www.hospitalsantamonica.com/id41.htm
Источник